Гепатологія. – 2008. – № 1. – С. 7–16.
Загальні відомості. Мутації НВV – це відносно постійна зміна генетичного матеріалу, яка відбувається спонтанно або під впливом зовнішніх мутагенів. Внаслідок мутацій виникають варіанти вірусу гепатиту В, що відрізняються від прототипних штамів НВV за нуклеотидними послідовностями DNA. Особливості реплікації НВV – зворотна транскрипція з утворенням прегеному (використання DNA-вірусом РНК для реплікації) і відсутність механізмів контролю за зчитуванням у 4-х відкритих рамках, що перекриваються, в умовах інтенсивної реплікації створюють можливості для різноманітних генетичних модифікацій [1]. Середня частота ймовірних мутацій у геномі НВV становить 1–3 x 105 [2].
Безпосередні причини мутацій найчастіше пов’язані з помилковим об’єднанням пар між матрицею та прогенним DNA-ланцюгом, впливом клітинних топоізомерів і сплайсінг гена, використанням донорних та акцепторних сайтів. Цим процесам сприяє також і відсутність у вірусу власної трансвертази (використання клітинних ферментів).
Мутаціям піддаються всі гени НВV, які можна згрупувати так: мутанти pre-S/S гена, pre-core/core гена, мутанти гена зворотної транскриптази (Р) та мутанти Х гена [3].
Поширеним є співіснування дикого та мутантного штамів, тобто інфекція за змішаним типом, для якої характерні доповнення матриць DNA за рахунок рекомбінацій. За даними Brunetto і співавт. найчастішою є мутація із заміною пуринів на піримідини та навпаки. Таку мутацію за pre-core/core виявлено в 34 із 55 мутантних ізолятів (61,8%); переважно це трансдикція; мутації pre-S/S виявлені лише в 9 штамах (16,7%), а зміни гена полімерази – у 12 вірусних ізолятах (21,8%) [4]; частими є і мутації Х-гена.
Хоч мутації НВV (вставки, заміни, делеції, перебудова нуклеотидів) можуть не спричиняти істотних наслідків, все ж вони часто призводять до появи нових епітопів, а це впливає на чутливість організму до НВV і, відповідно, на імунологічне реагування.
Головними причинами мутацій вважається імунний пресинг та вплив противірусної терапії, хоча визнається можливість «спонтанного» розвитку з інших, невстановлених причин.
Вірусний мутагенез, що передбачає розвиток і подальший відбір штамів, більшою мірою резистентних до захисних сил організму, розглядається як еволюційне пристосування, що надає збуднику переваг, порівняно з диким НВV. Після кожної чергової імунної атаки відбувається селекція найбільш пристосованих, здатних до подальшої модифікації штамів. Тому зі значною тривалістю хвороби генетичні зміни стають все складнішими, а лікування відповідно менш ефективним. У цьому відношенні деякі мутації змінюються як функція в часі [5,6].
Мутації, наслідком яких є резистентність до імунної відповіді, одержали в літературі назву мутантів імунної втечі; зміни, якими супроводжується резистентність до терапії, – мутантів терапевтичної втечі. Дані про найчастіші мутації, їх можливі наслідки наведені у табл. 1.
Мутації S-гена. Питання про мутації НВV взагалі і S-гена зокрема вперше постало у зв`язку з недостатньою ефективністю вакцинації проти гепатиту В. Захворювання вакцинованих, у крові яких виявлено достатній вміст протективних антитіл, вказували на невідповідність антитіл антигенові. У 1988 р. Zanetti зі співат. описали 44 такі спостереження. Надалі в одного з пацієнтів було встановлено заміну нуклеотиду А на G в “а”-ділянці S-гена HBV. Наслідком цього стала заміна амінокислоти аргініну на гліцин у структурі групоспецифічної а-детермінанти НВsAg [7, 8].
Хоча відомі близько 30 видів мутацій S-гена, саме така модифікація вважається основною причиною захворювань вакцинованих дітей, що народилися від HBV-інфікованих матерів [9–11].
Захворювання вакцинованих дітей найчастіше пояснюють мутаціями, які виникають під впливом поствакцинальних антитіл або внаслідок імуноглобулінопрофілактики гепатиту В. Підтвердження цьому вбачають у тому, що мутації вірусу часто виникали у вагітних жінок, яким з метою попередження інтранатальної передачі НВV вводили імуноглобулін з високим вмістом anti-HBs. Аналогічна ситуація помічена й у хворих, які до і після трансплантації печінки тривало отримували препарат специфічного імуноглобуліну: в них “de novo” утворювалися мутантні штами НВV [12, 13].
Пізніше було встановлено, що введення специфічного імуноглобуліну призвело до зростання частоти мутацій, зумовлених заміною гліцину на аргінін у 145 амінокислотній позиції, одначе описані і випадки делеції у зоні накладання core гена та Х-гена.
Із впровадженням масової імунізації населення ймовірно пов’язане зростання кількості штамів з мутаціями а-детермінанти. Гетерогенність амінокислотної послідовності ускладнює діагностику гепатиту В, оскільки різні тест-системи відрізняються за здатністю реагувати з генетично модифікованим НВsAg. Саме тому актуальною є проблема створення тест-систем з моноклональних антитіл, які б одночасно реагували з диким та мутантним штамом [14].
З появою штамів НВV із мутаціями у генах оболонки антитіла перестають реагувати зі зміненим НВsAg, а імунокомпетентні клітини можуть втрачати здатність виявляти цей антиген. Поширення мутацій у НВsAg-кодуючій ділянці пояснює розвиток НВsAg-негативного гепатиту В.
З розробкою вакцин, що містять НВsAg з кодованою pre-S та pre-S-2 зонами DNA, повинна зменшитися кількість мутації, пов’язаних з вакцинацією [15].
З розробленням полімеразної ланцюгової реакції з’явилися численні повідомлення про так званий німий гепатит, коли у хворих з реплікацією НВV не вдається виявити НВsAg [16–18]. Але було б помилковим пояснювати всі випадки НВsAg-негативного гепатиту мутаціями S-гена .
«Відсутність» НВsAg у хворих на ХГВ зумовлена багатьма причинами, зокрема, утворенням імунних комплексів або інтеркуренцією вірусів. Та найчастіше низький рівень продукції або відсутність НВsAg пояснюють мутаціями S-гена.
У клінічній практиці висновки про мутації S гена роблять на підставі «відсутності» НВsAg у хворих з реплікацією HBV DNA. На можливість такої мутації вказує також одночасна наявність у крові хворого НВsAg та HBsAb. Так, у 89% пацієнтів, що мали одночасно НВsAg та антитіла до нього, виявлено варіанти по “а”-епітопу або змішану форму інфекції (дикий тип вірусу та мутант) [19].
Вивчення основних типів pre-S делеційних мутантів (140 взірців сироватки крові і 18 тканини печінки хворих на ХГВ) встановило, що делеційна послідовність ділянки печінкового мутанту НВV відповідає HLA епітопам Т- і В-клітин. Це створює певну перевагу, через можливість вибіркової проліферації гепатоцитів з pre-S2 мутантом. Такі мутанти частіше виявлялись у хворих із низьким вмістом або відсутністю НВV DNA [16].
За даними літератури, у різних регіонах escape-мутанти виявляють у 5–22% інфікованих НВV [20,21], серед НВsAg-негативних хворих на ХГВ – у 50% обстежених [22].
Хворі з “німим” варіантом НВV-інфекції стають джерелом інфекції при гемотрансфузіях і трансплантації печінки [23,24]. Саме тому, в останні роки більше уваги стали приділяти іншим маркерам, зокрема HBcAb. Так, у Венесуелі при дослідженні 258 взірців крові, позитивних за anti-HBc (за відсутності НВsAg), у 11 виявлено НВV DNA (4,3%). Переважно це спостерігалось у взірцях крові з високими титрами HBcAb. Філогенетичний аналіз послідовностей ділянок геному НВV показав, що частина НВsAg-негативних взірців крові з DNA НВV мала змішану інфекцію (одночасно диким та мутантним штамами) або був присутній рекомбінантний варіант вірусу [25]. Через наявність НВsAg-негативного гепатиту пропонується обстежувати донорів крові на інші маркери інфекції – anti-HBc та anti-HBs, особливо підозрілим вважається наявність ізольованих anti-HBc.
У наших дослідженнях у хворих, що мали anti-HBc (за відсутності НВsAg), реплікація була виявлена у 6,92% обстежених [26]. За даними літератури, цей показник може сягати 10% і навіть більше.
Комерційні тест-системи можуть відрізняться за здатністю виявляти НВsAg з точковими мутаціями “а”-детермінанти, тому використання панелі діагностичних тест-систем підвищує ефективність дослідження [27].
Суперечливі результати при дослідженні одного взірця кількома тест-системами часто зумовлено модифікацією антигена. Через це деякі дослідники, вивчаючи мутації S гена, попередньо підшукують досліджувальні взірці, що реагують лише з деякими діагностичними сироватками з панелі.
Мутації core гена. Питання про мутаційні зміни у pre-core та core регіоні гена HBV вперше постало у зв’язку з відсутністю HВeAg у хворих із реплікацією HBV DNA. Сьогодні встановлено, що відбувається поступове заміщення «дикого» штаму віруса гепатиту В штамом, що позначається, як мутантний за «Pre-Core HBV DNA» .
Питання, що стосуються pre-core/core мутацій, крім теоретичного, набуло й прикладного значення: розглядається вплив мутацій на клінічні особливості гострого та хронічного гепатиту В, вивчаються деталі імунопатогенезу, HBeAg-негативність враховується при виборі алгоритму лікування ХГВ[28].
До припинення синтезу HВeAg можуть призводити зміни на етапі транскрипції (мутації в core-промоторі) та на стадії трансляції.
Найчастішою мутацією є заміна гуанінової (G) основи на аденін (А) у положенні 1896. Із заміною G на А утворюється трансляційний стоп-кодон (ТАG) – припиняється експресія pre-С/С протеїну, що є попередником синтезу HBeAg. У цьому випадку припинення синтезу HBeAg відбувається на рівні трансляції. Важливо, що ця мутація не впливає на будову капсиду і не порушує реплікацію [29]. Більше того, через втрату найімуногенішого е- антигену починає формуватися толерантність до HBV, зменшується імунний апоптоз і, відповідно, сповільнюється кліренс HBV. За таких умов мутант отримує перевагу над диким штамом, відбувається його відбір та закріплення модифікації [30].
Мутанти pre-core/C-гена зустрічаються повсюдно, хоча і з різною частотою. У клінічних дослідженнях уявлення про поширеність таких мутацій зазвичай роблять на підставі вивчення частоти HBeAg-негативних форм ХГВ. У огляді літератури з цього питання (проаналізовано 50 літературних джерел) показано, що поширеність е-негативного ХГВ у середземноморському регіоні становить 33%, на Далекому Сході – 15% та 14% – у Північній Європі та США [30]. Хоча не всі випадки HBeAg-негативності зумовлені саме pre-core мутацією, все ж варіант з pre-core модифікацією виявлений в середньому у 60% таких хворих. У регіонах, де домінує генотип D, цей показник наближається до 100%: в абсолютній більшості хворих із сероконверсією на HBеAb виявляють мутації pre-core та core-ділянки.
У генотипів ні-А залишок G в положенні 1896 в нормі утворює пару з Т (U) в 1856 положенні та з С в А генотипі. Із заміною G на A в позиції 1896 утворюється нестабільна пара А–С у цій позиції. Натомість у ні-А генотипах ця мутація сприяє утворенню Уотсон-Криківської пари Т(U)-A, що стабілізує вторинну структуру і сприяє реплікації [31]. Саме тому у регіонах, де домінує А генотип HBV, e-негативність реєструється значно рідше, часто пов`язана з іншими перетвореннями геному; серед хворих з HBeAg-негативним гепатитом переважає генотип D вірусу [32].
Генотип А поширений у країнах Західної Європи, Центральної Африки, Східної Америки, а D – у регіоні Середземномор’я. Розподіл генотипів HBV в країнах Східної Європи, зокрема в країнах СНД, вивчено ще не недостатньо. Тим не менш, з’явилися повідомлення, що у Росії переважає генотип D, частка якого серед інших генотипів HBV – понад 90% [33]. В Україні, за даними Т.І. Лядової, як і у Росії, домінує генотип D вірусу [34]. При обстеженні 166 хворих його частка становила 89,4% (генотип А виявлено лише у 5,9% хворих).
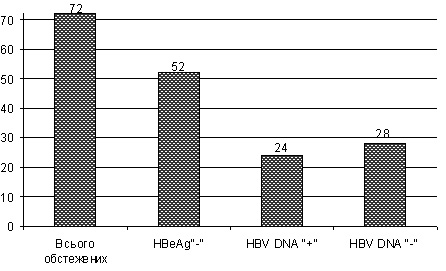 Рис.1. Виявлення HBV DNA у HBeAg-негативних хворих на ХГВ
Рис.1. Виявлення HBV DNA у HBeAg-негативних хворих на ХГВ
Особливості генотипової структури HBV в Україні вказують на можливу поширеність HBeAg-негативного ХГВ. І дійсно, сьогодні відомо, що HBeAg-негативний ХГВ не обмежений регіоном Середземномор’я, у якому вперше був виявлений. За нашими даними [26], у Західних областях України більше, ніж у третини хворих на ХГВ, реплікація HBV DNA відбувається за відсутності її серологічного маркера – HBeAg. Так, при обстежені 72 хворих на ХГВ НВeAg вдалося виявити лише у 20 з них (27,8%); у 52 пацієнтів НВeAg не було (72,2%). Із цієї кількості НВeAg-негативних хворих у 24 (46,2%) виявлено HBV DNA, тобто встановлено реплікативну форму ХГВ. У загальній кількості обстежених пацієнтів (72 хворих) цей показник становить 33,3% (рис.1), тобто у третини хворих на ХГB встановлена реплікація HBV DNA за відсутності її серологічного маркера.
Ще частіше така форма інфекційного процесу зустрічається у хворих на цироз печінки (табл.2).
Переважання HBeAg-негативної форми реплікації у хворих на цироз печінки ймовірно вказує на більшу небезпечність цієї форми інфекційного процесу.
Більшість дослідників констатують зростання кількості НВeAg-негативного ХГВ зі збереженням реплікації HBV DNA. На міжнародній конференції «Нові напрямки у гепатології» у Мінську 1–2 лютого 2008 р. M. Rizzetto навів дані, що демонструють швидке й істотне збільшення питомої ваги НВеAg-негативного ХГВ в Італії (рис.2). Аналогічна тенденція спостерігається у більшості країн Європи.
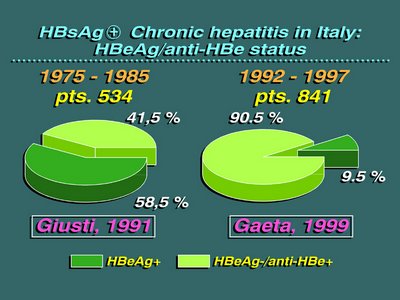 Рисунок 2. Динаміка частоти HBeAg-негативного ХГВ у Італії
Рисунок 2. Динаміка частоти HBeAg-негативного ХГВ у Італії
Найімовірнішою причиною цього явища може бути все ширше застосування противірусної терапії.
Проблема мутації core гена HBV, що призводить до якісно іншої форми ХГВ, належить до найактуальніших проблем гепатології.
Мутації гена полімерази (Р) найчастіше зумовлені заміною метіоніну на валін або ізолейцин у 195–196 кодонах. Вони часто пов’язані з противірусною терапією аналогами нуклеозидів – в першу чергу ламівудином. Ламівудин блокує зворотну транскрипцію і таким чином пригнічує реплікацію HBV DNA, та тривала терапія ламівудином призводить до мутацій, руйнуючих локус YMDD (тирозин, метіонін, аспартат, аспартат) гена полімерази. Наслідком цього є формування резистентності до ламівудину [35,36]. На 41 щорічному засіданні Європейської асоціації з вивчення печінки (Відень, 2006) наводились дані, згідно яких 70% хворих на четвертий рік лікування стають нечутливими до ламівудину. Саме тому протягом терапії хронічного гепатиту ламівудином доцільно проводити моніторинг YMDD-мутації. Для цього застосовується алельспецифічна полімеразна ланцюгова реакція. Подібні мутації можуть виникати і у разі лікування фамцікловіром, однак явище це є менш поширеним. Віруси, резистентні до ламівудину та фамцикловіру зберігають чутливість до ряду інших нуклеозидних аналогів.
Література
- Mimms L. Hepatitis B virus escape mutants: ‘‘pushing the envelope’’ of chronic hepatitis B virus infection // Hepatology. – 1995. – Vol. 21. – Р. 884–887.
- Буеверов А.О. Мутации вируса гепатита В их клиническое значение // Клинические перспективы гастроэнтерологии, гепатологии. – 2003. – № 4. – С. 7–12.
- Шерлок Ш., Дули Дж. Заболевания печени и желчных путей / Пер. с англ. – М.: Геотар Медицина, 1999. – 859 с.
- Brunetto M.R., Rodriguez U.A., Bonino F. Hepatitis B virus mutants // Intervirology. – 1999. – Vol. 42. – Р. 69–80.
- Chuang W.L., Omata M., Ehata T. et al. Concentrating missense mutations in core gene of hepatitis B virus. Evidence for adaptive mutation in chronic hepatitis B virus infection // Dig. Dis. Sci. – 1993. – Vol. 38. – Р. 594–600.
- Feitelson M., Lega L., Guo J. et al. Pathogenesis of posttransfusion viral hepatitis in children with α -thalassemia // Hepatology. – 1994. – Vol. 19. – Р. 558–568.
- Carman W.F., Zanetti A.R., Karayiannis P. et al. Vaccine-induced escape mutant of hepatitis B virus // Lancet. – 1990. – Vol. 336. – P. 325–329. Abstract.
- Chen W.N., Oon C.J., Koh S. Horizontal of a human hepatitis B virus surface antigen mutant // J. Clin. Microbiol. – 2000. – Vol. 38. – P. 938–939.
- Ngui S.L., O`Connell S., Eglin R.P. et al. Low detection rate and material provenance of hepatitis B virus S gene mutants in cases of failed postnatal immunoprophylaxis in England and Wales // J. Infect. Dis. – 1997. – Vol. 176. – P. 1360–1365.
- Oon C.J., Chen W.N. Current aspects of hepatitis B surface antigen mutants in Singapore // J. Viral. Hepat. – 1998. – Vol. 5, Suppl. 2. – S. 17–23.
- Kreutz C. Molecular, immunological and clinical properties of mutated hepatitis B viruses // J. Cell. Mol. Med. – 2002. –Vol. 6, № 1. – P. 113–143.
- Ikeda K., Arase Y., Kobayashi M. et al. Hepatitis B virus-related hepatocellular carcinogenesis and its prevention // Intervirology. – 2005. – Vol. 48, № 1. – P. 29–38.
- Protzer Knolle U., Naumann U., Bartenschlager R. et al. Hepatitis B virus with antigenically altered hepatitis B surface antigen is selected by high-dose hepatitis B immune globulin after liver transplantation // Hepatology. – 1998. – Vol. 27. – P. 254–267.
- Уланова Т.И., Yokosawa J., Пузырев В.Ф. и др. Влияние гетерогенности аминокислотной последовательности детерминанты а на антипенные свойства HBsAg вируса гепатита В. // Вопросы вирусологии. – 2007. – №3. – С. 13–15.
- Шахгильдян И.В., Михайлов М.И., Онищенко Г.Г. Парентеральные вирусные гепатиты. (Эпидемиология, диагностика, профилактика). – М.: ГОУ ВУНМЦ. МЗ. РФ, 2003. – С.384.
- Davis G.L. Hepatitis B: diagnosis and treatment // South Med. J. – 1997. – Vol. 90. – P. 866–870.
- Абдурахманов Д.Т. Клиническое значение и трудности диагностики латентной НВV инфекции // Вирусные гепатиты. Достижения и перспективы: Информ. бюл. – 2002. – № 1. – С. 11–16.
- Ильина Е.Н., Говорун В.М., Иваников И.О. Некоторые аспекты лабораторной диагностики вирусных гепатитов В и С // Тер. архив. – 2003. – № 4. – С. 84–86.
- Mesenas S.J., Chow W.C., Zhao Y. et al. Wild-type and ‘a’ epitope variants in chronic hepatitis B virus carriers positive for hepatitis B surface antigen and antibody // J. Gastroenterol. Hepatol. – 2002. – Vol. 17, № 2. – P. 148–152.
- Hsu H.Y., Chang M.H., Liaw S.H. et al. Changes of hepatitis B surface antigen variants in carrier children before and after universal vaccination in Taiwan // Hepatology. – 1999. – Vol. 30. – P. 1312–1317.
- Oon C.J., Chen W.N., Zhao Y. et al. Detection of hepatitis B surface antigen mutants and their integration in human hepatocellular carcinoma // Cancer Lett. – 1999. – Vol. 136. – P. 95–99.
- Carman W.F. The clinical significance of surface antigen variants of hepatitis B virus // J. Viral. Hepatitis. – 1997. – Vol. 4, Suppl 1. – Р. 11–20.
- Chazouilleres O., Mamish D., Kim M. et al. “Occult” hepatitis B virus as a source of infection in liver transplant recients // Lancet. – 1994. – Vol. 343. – P. 142–146.
- Uemoto S., Sugiyama K., Marusawa H. et al. Transmission of hepatitis B virus from hepatitis B core antibody-positive donors in living related liver transplants // Transplantation. – 1998. – Vol. 65. – P. 494–499.
- Gutierrez C., Devesa M., Loureiro C.L. et al. Molecular and serological evaluation of surface antigen negative hepatitis B virus infection in blood donors from Venezuela // J. Med. Virol. – 2004. – Vol. 73, № 2. – Р. 200–207.
- Герасун Б.А., Ворожбит О.Б, Герасун О.Б., Бірка Ю.І., Тичка І.Б., Русин О.І. Гепатити В та С у хворих, які лікуються програмним гемодіалізом // Інфекційні хвороби. – 2006. – №2. – С. 24–27
- Герасун О.Б. Актуальні аспекти специфічної діагностики хронічного гепатиту В // Практична медицина. – 2004. – №1.– С. 63–66.
- Корчинский Н.Ч., Король З.Р. Мутантне штамы вируса гепатита В и их клиническое значение // Сучасні інфекції. – 2006. – №1–2. – С. 36–38.
- Ogata N., Miller R.H., Ishak K.G., Purcell R.H. The complete nucleotide sequence of a pre-core mutant of hepatitis B virus implicated in fulminant hepatitis and its biological characterization in chimpanzees // Virology. – 1993. – Vol. 194. – P. 263–276.
- Funk M.L., Rosenberg D.M., Lok A.S. World-wide epidemiology of HBeAg-negative chronic hepatitis B and associated precore and core promoter variants // J. Viral. Hepat. – 2002. – Vol. 9, № 1. – P. 52–61.
- Kramvis A., Bukofzer S., Kew MC, Song E. Nucleic acid sequence analysis of the precore region of the hepatitis B virus from sera of southern African black adult carriers of the virus // Hepatology. – 1997. – Vol. 25. – P. 235–240.
- Grandjacques C., Pradat Kramvis A., Bukofzer S., Kew MC, Song E. Nucleic acid sequence analysis of the precore region of the hepatitis B virus from sera of southern African black adult carriers of the virus // Hepatology. – 1997. – Vol. 25. – P. 235–240.
- Мукомолов С.Л., Калинина О.В. Молекулярная эпидемиология вирусных гепатитов // Мир вирусн. гепатитов. – 2003. – № 11. – С. 2–7.
- Лядова Т.І. Клініко-генетичні дослідження та роль цитокінової регуляторної мережі в патогенезі гострого вірусного гепатиту В: Автореф. дис. … канд. мед. наук: 14.01.13 / Інститут епідеміології та інфекційних хвороб ім. Л.В. Громашевського АМН України. – К., 2004. – 24 с.
- Liaw Y.F., Chien R.N., Yeh C.T. No benefit to continue lamivudine therapy after emergence of YMDD mutations // Antivir Ther. – 2004. – Vol. 9, № 2. – P. 257–262.
- Yeh C.T., Chien R.N., Chu C.M.; Liaw Y.F. Clearance of the original hepatitis B virus YMDD-motif mutants with emergence of distinct lamivudine-resistant mutants during prolonged lamivudine therapy // Hepatol. – 2000. – Vol. 31, № 6. – P. 1318–1326.
Мутанты вируса гепатита В: прикладные аспекты
А.Б.Герасун
В статье приведены данные о влиянии мутаций НВV на клинику, диагностику и лечение гепатита В, представлены результати изучения HBeAg-негативного ХГВ в Западной Украине.
Ключевые слова: HBV, HBsAg, HBeAg, мутация, S-ген, Core-ген, Р-ген, Х-ген
Mutant of virus hepatitis B apliet aspects.
O.B.Herasun
Effects about virus hepatitis B Mutation influence on clinic diagnostic and treatment of hepatitis B have been mentioned in the article. Results of research HBeAg-negative Chronic hepatitis B in Western region were represented.
Key words: HBV, HBsAg, HBeAg, mutation, S-gene, Core- gene, Р- gene, Х gene.


