Гепатологія – 2009. – № 1 – C. 28–36.
Сучасна гепатологія має досить значний арсенал прижиттєвих методів дослідження – лабораторні аналізи, ультразвукове дослідження та інші. Їх ефективність інтенсивно вивчається на основі різноманітних клінічних досліджень. Багато зусиль докладається для розробки діагностичних алгоритмів по виявленню етіологічних маркерів різноманітних захворювань, а також для визначення стадії розвитку та ступеня активності патологічних процесів. Типовим прикладом може бути впровадження у практику тестів для діагностики стеатозу, фіброзу та ступеня активності (FibroTEST, ActiTEST, SteatoTEST), розроблених французькими дослідниками. Вони базуються на виявленні кореляції між групою лабораторних показників та ступенем вираженості окремих патологічних процесів. Проте, незважаючи на привабливість використання подібних алгоритмів, їх достовірність на сьогодні визнається далеко не всіма дослідниками [1].
У сучасних схемах обстеження пункційна біопсія печінки (ПБП) вважається «золотим стандартом» діагностики хронічних захворювань печінки, оскільки дозволяє встановити:
- Діагноз (відомі гістологічні маркери захворювань);
- Активність процесу у печінці (індекс гістологічної активності);
- Ступінь хронізації процесу у печінці, тобто стадію (індекс) фіброзу;
- Ефективність терапії (біопсії в динаміці);
- Прогноз
У світі понад 50% ПБП виконуються з приводу ХГС. Згідно рекомендацій Консенсус Конференції Європейської асоціації з вивчення печінки (EASL), ПБП повинна виконуватись хворим на ХГС при первинному встановленні діагнозу і що 4 роки при подальшому спостереженні. За підрахунками Cadranel JF. та співавт щороку у Франції повинно було б виконуватись 166666 біопсій на рік, а фактично було виконано лише 8000 біопсій, тобто 5% від необхідної кількості. З чого автори роблять висновок, що ступінь гістологічних змін залишається невідомими у 95% хворих на ГС. В Україні тільки в окремих клініках цей метод впроваджений у клінічну практику [2].
За історичними даними біопсію печінки вперше виконав в 1883 році Еріх в Німеччині для вивчення вмісту глікогену в печінці при цукровому діабеті, а потім в 1895 році Лукателло в Італії для діагностики амебного абсцесу печінки.
Таблиця 1. Історичні дані запровадження пункційної біопсії печінки.
|
Автори |
Рік |
Країна |
Мета |
|
Еріх |
1883 |
Німеччина |
Вивчення вмісту глікогену печінки |
|
Лукателло |
1895 |
Італія |
Діагностика амебного абсцесу печінки |
|
Шупфер |
1907 |
Франція |
Діагностика цирозу печінки |
|
Хьюар та співавт. |
1935 |
Франція |
Загальнодіагностична |
|
Барон |
1939 |
США |
Загальнодіагностична |
|
Івер сон та Рохолм |
1939 |
Данія |
Діагностика гепатиту |
|
Аксенфельд і Брасс |
1942 |
Німеччина |
Діагностика гепатиту |
|
Дубль та співав. |
1943 |
Великобританія |
Діагностика гепатиту |
Результати серійних біопсій з метою діагностики цирозів та пухлин печінки вперше опубліковані в 1907 році Шупфером у Франції [2]. Однак метод не дістав широкого розповсюдження аж до 30-их років минулого століття, коли Хьар та співавтори у Франції та Барон у США стали використовувати біопсію печінки з загально діагностичною метою. Під час другої світової війни кількість біопсій печінки різко виросла, завдяки впровадженню цього методу для вивчення вірусних гепатитів з доброякісним перебігом [3].
На даний час практично кожен лікар в розвинутих країнах, та й не тільки, може освоїти техніку пункційної біопсії печінки. Змінилися покази до біопсій печінки, її техніка, покращилась діагностика ускладнень, значно знизився ризик виникнення ускладнень.
На сьогоднішній день показами для ПБП є:
- Гострий гепатит.
- Медикаментозний гепатит.
- Хронічний гепатит.
- Цироз печінки та портальна гіпертензія.
- Ураження печінки у алкоголіків.
- Внутрішньо печінковий холестаз.
- Інфекції.
- Хвороби накопичення.
- Період після трансплантації печінки.
- Ускладнення зі сторони печінки після трансплантації нирки.
- Вогнищеві ураження печінки.
- Гепатомегалія або підвищення рівня ферментів нез’ясованої етіології.
Тканина біоптату печінки може бути морфологічно досліджена на цитологічному та гістологічному рівні. Цитологічне дослідження виконується в цитологічних лабораторіях, які входять до складу лікарняних відділень лабораторної діагностики. Цитологічне дослідження має одну дуже важливу перевагу – його можна провести швидко, навіть протягом години, але отримати інформацію про патологічну трансформацію на тканинному рівні за допомогою цього методу неможливо. Так, цитологічно можна надійно діагностувати метастатичне ураження печінки, але встановити індекс активності хронічного гепатиту або ступінь розвитку фіброзу вдається лише при гістологічному дослідженні, яке виконується в патогістологічних лабораторіях.
На сьогодні використовуються наступні методики проведення біопсії печінки:
- Сліпа черезшкірна біопсія міжреберним доступом за Menghini .
Біопсія з проведенням місцевого гемостазу:
- Трансвенозна (транс’югулярна або трансфеморальна) біопсія
- Лапароскопічна біопсія
Найбільш поширеною є перша з перерахованих методик. При цьому застосовуються голки різних типів, які дозволяють одержувати тканину різними шляхам. При використанні голки аспіраційного типу (Menghini або тонкої голки) створюється вакуум та аспірується тканина. При цьому голки різної товщини дозволяють одержати матеріал, достатній для діагностики і максимально врахувати як недоліки, так і переваги кожної з них. Тонкоголкова біопсія, яка використовується при цитологічному дослідженні, дозволяє розпізнати карциному, але для діагностики хронічного гепатиту матеріалу буде недостатньо; при використанні голки Menghini матеріал з циротично зміненої печінки може бути фрагментованим, що затруднює діагностику. При застосуванні голки типу Tru-cut висікається стовпчик тканини (якість краща, але при вогнищевих процесах аспірація дозволяє одержати додатковий матеріал з прилягаючої тканини і відповідно планувати лікування) [4].
Для виконання біопсій хворих зазвичай госпіталізують, хоча можливе виконання біопсії і в амбулаторних умовах коли відсутня жовтяниця або такі ознаки декомпенсації як асцит та печінкова енцефалопатія. Маніпуляція має проводитись при загального білірубіну не вижче ніж 70 мкмоль/л.
Не варто проводити біопсію амбулаторним хворим з цирозом та пухлинами печінки. Кількість тромбоцитів має бути не меншою ніж 80 * 109/л. При тромбоцитопенії ризик кровотечі залежить в більшій степені від функціонального стану тромбоцитів ніж від їх кількості. У хворих з гіперспленізмом та кількістю тромбоцитів менше ніж 60 * 109/л ймовірність кровотечі менша, ніж у хворого з лейкозом з тією ж кількістю тромбоцитів. Цю обставину треба особливо брати до уваги у пацієнтів з захворюваннями крові або після трансплантації органів при уточненні впливу на печінку цитостатичної терапії, вірусів, інших інфекційних агентів, хвороби «трансплантат проти господаря». У таких хворих біопсію вважають безпечнішою, якщо з допомогою трансфузій тромбоцитів можна збільшити їх кількість більше ніж 60 на 109. Підвищеної уваги вимагають хворі після алкогольного ексцесу, у зв’язку із зменшенням кількості тромбоцитів та їх дисфункції, особливо після прийому ацетилсаліцилової кислоти. Біопсія не рекомендується при напруженому асциті так як отримати зразок тканини печінки практично ніколи не вдається. З 155 біопсій виконаних у хворих на гемофілію у клініці Колумбійського університету (США), тільки 12,5% ускладнились кровотечами [5].
Часто спостерігаються варіації анатомічної будови та розмірів печінки. При невеликій печінці голка може не досягнути до органу, при порушенні анатомічних співвідношень можлива пункція жовчного міхура або великих кровоносних судин в воротах печінки. Тому біопсію слід проводити під контролем УЗД, для уточнення розмірів печінки, розміщення жовчного міхура та анатомічних відхилень.
Техніка біопсії: Для проведення пункції хворого вкладають на лівий бік. Прокол печінки проводиться в восьмому-десятому міжребер‘ї справа, між передньою аксілярною та середньоключичною лінією під контролем ультразвуку. Контроль проводиться безперервно за допомогою УЗ сканера SONOSCAPE SS1-1000 конвексним полічастотним датчиком 2,5-5 МГц. Шкіру обробляється 70% розчином етилового спирту, після чого застосовується анестезія 2% розчином лідокаїну, спочатку внутрішньошкірно, потім обезболюються м‘язи, плевра та капсула печінки. Через 1-2 хвилини проколюється шкіра за допомогою стилету на глибину 2-4 мм. Через намічене місце вводиться голка для пункційної біопсії печінки “Sterylab S.r.l.” G18, перпендикулярно до поверхні ребра та проводиться забір матеріалу. Отриманий стовпчик біоптату печінки мав мати довжину не менше 15 мм. На місце проколу клали стерильну пов‘язку. Одразу після пункції на ділянку правого підребер‘я накладається лід, який хворий тримає, з перервами, протягом двох годин.
Біопсія може бути невдалою при цирозі печінки, особливо при наявності асциту. В щільну печінку набагато важче ввести голку, при цьому можна отримати недостатню кількість паренхіми через розростання фіброзної тканини. Іншою перешкодою може бути емфізема легень, так як печінка при цьому опущена внаслідок низького стояння діафрагми і голка може пройти над нею. Причиною невдалої біопсії може бути недостатньо гостра голка, що не дозволяє проколоти капсулу печінки. Тому необхідно використовувати одноразові голки.
Летальність після біопсій по статистичним даним складає 0,01%. Розвиток ускладнень у 0,06%-0,32% хворих.
Незважаючи на низьку летальність та невисокий рівень розвитку ускладнень біопсію печінки необхідно виконувати тільки в тому випадку коли хворий може розраховувати на користь від інформації і цю інформацію неможливо отримати іншим шляхом.
Ускладнення, які можуть виникнути під час біопсії печінки [6]:
- Плеврит та перигепатит – на наступний день після біопсії може вислуховуватись шум тертя очеревини або плеври, що обумовлений фіброзним плевритом або пери гепатитом. Особливого значення це ускладнення не має і корегується прийомом анальгетиків. Можливий незначний пневмоторакс, що виявляється рентгенографічно.
- Кровотеча – В серії з 9212 біопсій кровотеча спостерігалась у 10 хворих (0,11%) з летальним наслідком та у 22 (0,24%) з несмертельною кровотечею []. До факторів ризику виникнення кровотеч відносять: злоякісні новоутвори печінки, жіноча стать, багаторазові спроби біопсії. Кровотеча як правило розвивається коли ризик її виникнення є невеликим. Це пов’язано з не порушенням згортання крові, а іншими факторами: концентрацією факторів згортання в паренхімі печінки та недостатнім механічним здавлюванням пункційного каналу еластичною тканиною печінки.
- Внутрішньо печінкові гематоми – виявляються через 2-4 години після біопсії за допомогою УЗІ. Ризик виникнення гематом – 2%
- Артеріовенозна фістула – ускладнює біопсію у 5,4% випадків.
- Жовчний перитоніт – друге після кровотеч за частотою виникнення ускладнень.
- Пункція інших органів – нирка, пряма кишка.
Інфекція – особливо часто виникає у хворих з холангітом. Найчастіша причина кишкова паличка. - Карциноїдний криз.
Таблиця 2. Фактори, що обмежують використання ПБП для оцінки морфологічних змін при ХГС.
|
Причини “непопулярності” біопсії печінки |
|
|
Наявність протипоказів |
порушення гемостазу, виражений холестаз, цукровий діабет, декомпенсовані серцево-судинні захворювання, правобічний ексудативний плеврит |
|
Потенційний ризик процедури |
59% хворих та 22% лікарів поділяють нерішучість щодо ПБ |
|
Побічні ефекти біопсії |
1 з 3-х відмічає біль, 1 з 1000 має важкі, часом загрожуючі життю ускладнення, 1 з 10000 ПБ закінчується летально |
|
Низька відновлюваність результатів |
30% ЦП не діагностується при ПБ При ЦП три зразки, узяті однаковою методикою в тих самих хворих, узгоджується лише у 50% випадків, розбіжності між результатами ПБ правої та лівої долей печінки відмінності у гістологічних заключеннях одного патолога тієї ж самої біопсії та між двома різними висококваліфікованими патологами |
|
Технічна складність процедури |
лише 50% виконаних ПБ відповідають вимогам – стовпчик 15 мм з ≥5 портальними трактами |
Для успішного гістологічного дослідження біоптат має бути достатнім за об’ємом. Ідеальна біопсія повинна бути довжиною 10-20мм (містити 5-6 портальних трактів – краще 11-12 ) та бути на достатній глибині (не менше 5 мм).
Якщо стовпчик тканини меншого розміру, патоморфолог повинен уважно дослідити весь матеріал і одержати максимум інформації від інвазивної процедури.
Матеріал краще брати традиційно з правої частки (доступ до лівої частки є легшим, але, оскільки циротична трансформація не є рівномірною, більш виражені зміни виявляються саме при цій локалізації).
Одержаний стовчик роміщується на поверхні скла, пластмаси або дерева (фільтрувальний папір використовувати не рекомендують, оскільки дрібні часточки можуть лишитись на тканині). При необхідності на цьому етапі проводиться висічення шматочків для додаткових досліджень, що потребують інших фіксаторів (імуногістохімія, замороження, електронна мікроскопія). Слід зазначити, що нефіксована тканина печінки дуже чутлива до механічного пошкодження, навіть тримання стовпчика тканини в пінцеті може безнадійно пошкодити матеріал. Для рутинного гістологічного дослідження (фарбування гематоксилін-еозином), що в більшості випадків клінічної діагностики цілком достатньо, основний матеріал фіксується у забуференому 10% формаліні (щонайменше протягом 3 годин при кімнатній температурі, коротший час – при вищій температурі); операційний матеріал потребує більш тривалої фіксації. Кількість готової фіксуючої рідини має перевищувати об’єм біоптату не менш, ніж в 10 разів, тобто при об’ємі стовпчика тканини в 2-3 мм3 достатньо 2-3 мл фіксатору. Якщо кількість і якість фіксатору достатня, біоптат може надійно зберігатись досить тривалий час, протягом декількох тижнів. Заморожування тканини або фіксація при низькій температурі в холодильнику не допускається, холодова травма гепатоцитів може призвести до незворотніх клітинних змін, які нерідко виключають надійний морфологічний діагноз. Для проведення гістохімічних, імуногістохімічних та електронномікроскопічних досліджень необхідні інші методи фіксації, тоді як формалінова фіксація в таких випадках унеможливлює застосування спеціальних морфологічних методів. Після стандартної проводки з одержаних парафінових блоків виготовляються серійні зрізи товщиною 3-5мкм (біля 10).
При виборі методів мікроскопічного дослідження найчастіше обмежуються обов’язковим мінімумом – забарвлення гематоксилін-еозином та методики для виявлення елементів сполучної тканини . В більшості випадків цього є цілком достатньо для діагнозу. При необхідності застосовуються гістохімічні методи: імпрегнація сріблом – виявлення порушень тканинної організації; трихром Массона – виявлення колагену (оцінка фіброзу, звужених судин у рубцях); орсеїн (або Victoria blue) – виявлення еластичних волокон (давність фіброзу), HBsAg, мідь-асоційованого протеїну; реакція Перлса – виявлення заліза (жовчі, ліпофусцину та інших пігментів); ШИК-реакція – виявлення глікопротеїнів (макрофагів з цероїдом, включення альфа-1-антитрипсину). Імуногістохімічні методи використовуються для достовірного виявлення антигенів вірусу гепатиту В, дельта антигену, цитомегаловірусу, включень а-1-антитрипсину, маркери біліарного епітелію при дуктопенії, пухлинні антигени [7].
При гістологічному дослідженні варто дотримуватись стандартного алгоритму, що дозволяє уніфікувати опис та наступне патоморфологічне заключення. Спочатку на малому збільшенні оцінюють загальну будову: якість біопсії, співвідношення портальних трактів та центральної вени ( збереження тканинної організації), наявнісь вираженого фіброзу, оцінка запального інфільтрату ( портальний, лобулярний, змішаний), інші ознаки ( наявність вузлів, застійні явища). Після цього на середньому та великому збільшенні досліджують портальні тракти, часточки та центральні вени. При цьому основним завданням є визначення наявності та ступеня вираженості основних патологічних процесів, які зустрічаються при різноманітних захворюваннях печінки. Зазвичай патоморфолог виявляє ознаки пошкодження, запалення, регенерації, склерозу та холестазу.
Таблиця 3. Патологічні процеси, що лежать в основі захворювань печінки.
|
Патологічний процес |
Варіанти та морфологічні прояви |
|
Пошкодження |
Дистрофія (зворотні та незворотні ознаки пошкодження з нагромадженням білків, жирів, вуглеводів, пігментів) Загибель клітин: апоптоз (еозинофільні тільця), некроз (вогнищеве випадіння гепатоцитів, зональнні, масивні некрози) |
|
Запалення |
Мононуклеарна інфільтрація (дрібні внутрішньочасточкові макрофагальні вузлики, на місці відповідних некрозів, пери портальна інфільтрація) |
|
Регенерація |
Проліферація гепатоцитів (вузли регенерати) та дуктулярна реакція |
|
Фіброз |
Перицелюлярний, перисинусоїдний, розширення портальних трактів, формування септ, вузлів |
|
Холестаз |
Внутрішньоканалікулярний, внутрішньопротоковий |
Поєднання проявів різних патологічних процесів дозволяє діагностувати захворювання, визначити його стадію та по можливості прогноз.
В ідеалі патоморфологічне заключення повинно містити опис виявлених морфологічних змін та діагностовану нозологічну форму. Але це не завжди можливо зробити.
Серед морфологічних проявів можна виділити більш та менш специфічні варіанти. Так, добре відомі маркери вірусного гепатиту В – «матово-склоподібні гепатоцити», які містять включення HBsAg, «пісочні ядра» з елементами геному віріонів, множинні апоптичні тільця (Каунсільмена), які вважаються майже патогномонічними. Досить однозначними є виявлення гемосидерину у гепатоцитах та клітинах Купфера при гемохроматозі, мідь-асоційованого протеїну при хворобі Вільсона. Для гепатиту С характерною є комбінація менш специфічних ознак – ураження міжчасточкових жовчевих протоків, лімфоїдні агрегати у портальних трактах, стовпчики лімфоцитів вздовж синусоїдів та нерівномірно виражена жирова дистрофія. Якщо ж виявлені зміни є неспецифічними у заключенні наводяться основні патологічні процеси [8].
Оскільки при більшості захворювань для розуміння прогнозу та розробки схеми лікування важливо визначити ступінь активності процесу та вираженість фіброзу, все більшого розповсюдження набувають напівкількісні шкали, які дозволяють оцінити ці показники. На сьогодні розроблені шкали для вірусного гепатиту С, неалкогольного стеатогепатиту та деяких інших захворювань [9].
При біопсійному дослідженні найчастішим питанням, яке стоїть перед патоморфологом є визначення особливостей виду та перебігу хронічного гепатиту: етіологічні маркери, ступінь активності та стадія розвитку захворювання. На сьогодні, коли етіологічний профіль хронічних гепатитів дещо змінився, зокрема, поширеність гепатиту С набуває характеру епідемії, виникла потреба у більш детальній та спеціалізованій оцінці морфологічних змін. Перша з напівкількісних шкал була створена групою дослідників під керівництвом Knodell, які описали три види альтеративно-запальних змін та четвертий варіант уражень – тканинну дезорганізацію та склероз. Ступінь вираженості таких змін визначалась у цифрах, що дозволяло в кінцевому результаті дати кількісну характеристику процесу. Дана система набула широкого розповсюдження, але в той же час виявились і недоліки – у випадках з вираженою активністю і незначним склерозом кількісні характеристики могли бути такими ж , як і при цирозі з низькою активністю процесу. Тому почалася активна робота по створенню нових напівкількісних шкал, яка продовжується і сьогодні. У відповідних оглядах літератури проводиться детальний аналіз цього питання, ми ж зупинимось лише на деяких питаннях, важливих я к для патоморфологів, так і для клініцистів [10].
Розроблені на сьогодні шкали можна умовно поділити на три групи, які відрізняються за призначенням:
- Максимально детальний опис виявлених морфологічних змін, які є важливими у дослідницькій роботі ( Knodell, Ishak)
- Проста схема, яка базується на ознаках з максимальною відтворюваністю результатів (METAVIR, Scheuer, Серов В.В.)
- Схематичні зображення, які полегшують сприйняття виявлених морфологічних змін для клініцистів (Batts-Ludwig)
Таблиця 4. Напівкількісна шкала METAVIR. Індекс гістологічної активності за METAVIR
| Ступінчасті некрози | Лобулярне запалення | ІГА |
| 0 (немає) | 0 (немає або незначне) | А0 (неактивний) |
| 1 (помірне) | А1 (низької активності) | |
| 2 (виражене) | А2 (помірної активності) | |
| 1 (незначні) | 0, 1 | А1 |
| 2 | А2 | |
| 2 (помірні) | 0, 1 | |
| 2 | А3 (високої активності) | |
|
3 (виражені) |
0, 1, 2 |
Гістологічний індекс склерозу
|
Опис фіброзу |
ГІС |
|
Немає фіброзу |
F0 |
|
Фіброз тільки портальних трактів |
F1 |
|
Фіброз портальних трактів + поодинокі септи |
F2 |
|
Фіброз портальних трактів + множинні септи без цирозу |
F3 |
|
Цироз |
F4 |
Таблиця 5. Напiвкількісна шкала Ishak K.G. et al ( 1995). Модифікований індекс гістологічної активності. (ступінь вираженості некрозапальних змін).
|
Зміни |
Бали |
|
А. Перипортальний або перисептальний гепатит (=interface hepatitis) (ступінчастий некроз) |
|
|
Відсутній |
0 |
|
Незначний (вогнищевий, декілька ПТ) |
1 |
|
Незначний/помірний (вогнищевий, більшість ПТ) |
2 |
|
Помірний (суцільно оточує < 50% ПТ або септ) |
3 |
|
Виражений (суцільно оточує >50% ПТ або септ) |
4 |
|
Зливні некрози |
|
|
Відсутні |
0 |
|
В. Вогнищеві зливні некрози |
|
|
Некроз у 3 зоні у деяких часточках |
2 |
|
Некроз у 3 зоні у більшості часточок |
3 |
|
Некроз у 3 зоні + поодинокі порто-центральні мостоподібні некрози |
4 |
|
Некроз у 3 зоні + множинні порто-центральні мостоподібні некрози |
5 |
|
Панацинарні або мультиацинарні некрози |
6 |
|
С. Вогнищеві (точкові) некрози – лізис, апоптоз, вогнищеве запалення (не включає дифузну інфільтрацію синусоїдів лейкоцитами) |
|
|
Відсутні |
0 |
|
Одне (або менше) вогнище в 1п/з при 10 х об’єктив |
1 |
|
1 – 4 вогнищ в 1п/з при 10 х об’єктив |
2 |
|
5 – 10 вогнищ в 1п/з при 10 х об’єктив |
3 |
|
Більше 10 вогнищ в 1п/з при 10 х об’єктив |
4 |
|
D. Запалення в портальному тракті |
|
|
Відсутнє |
0 |
|
Незначне, деякі або всі ПТ |
1 |
|
Помірне, деякі або всі ПТ |
2 |
|
Помірне/виражене, всі ПТ |
3 |
|
Виражене, всі ПТ |
4 |
|
Максимальна кількість |
18 |
Модифікований індекс тканинної перебудови (стадія фіброзу або цирозу)
|
Зміни |
Бали |
|
Фіброз відсутній |
0 |
|
Фіброзне розширення деяких ПТ з або без формування коротких фіброзних септ |
1 |
|
Фіброзне розширення більшості ПТ з або без формування коротких фіброзних септ |
2 |
|
Фіброзне розширення більшості ПТ з утворенням поодиноких порто-портальних септ |
3 |
|
Фіброзне розширення ПТ з вираженим утворенням порто-портальних та порто-центральних септ |
4 |
|
Множинні порто-портальні та порто-центральні септи з поодинокими вузлами (неповний цироз) |
5 |
|
Цироз, можливий або достовірний |
6 |
|
Максимальна кількість |
6 |
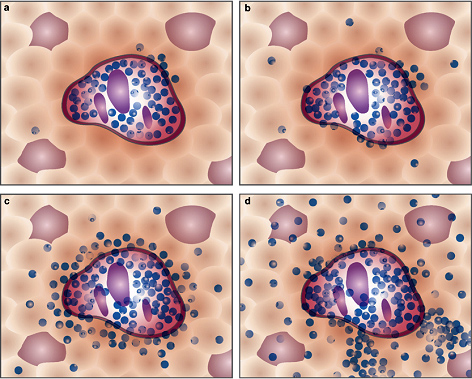
Діаграми Batts-Ludvig для визначення ступеня вираженості альтеративно-запальних змін
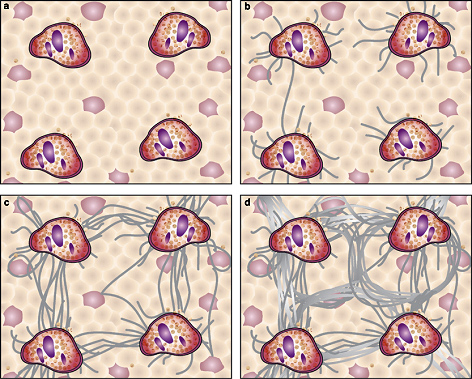
Діаграми Batts-Ludvig для визначення ступеня фіброзу та тканинної перебудови
Мал. 1. Діаграми Batts-Ludvig
Кожна із наведених та інші схеми мають свої переваги та недоліки, які детально обговорюються у відповідних спеціалізованих оглядах. Відповідно їх вибір залежить від уподобань да поглядів кожного патолога. Але існує певний мінімум вимог та рекомендацій, якого потрібно дотримуватись у кожному випадку біопсійного дослідження печінки. На нашу думку корисними можуть бути рекомендації відомого патолога Theise N., який спеціалізується у гематології.
На основі власного досвіду та аналізу багатьох літературних джерел він пропонує при дослідженні біопсії печінки при хронічних гепатитах дотримуватись наступних принципів [11,12]:
- Не має значення, яка із напівкількісних шкал вибрана, важливо, щоб була домовленість з клініцистом щодо доцільності використання певної схеми та розуміння її особливостей.
- У патогістологічному заключенні має бути вказана шкала, яка використовується. Вираженість процесу може бути представлена у вигляді цифр та/або у вербальній формі, оскільки діагноз має бути зрозумілим для будь-якого лікаря.
- При оцінюванні альтеративно-запальних змін важливо виявити зливні некрози, оскільки вони мають велике клінічне значення (загострення – при гепатиті С або агресивний перебіг при гепатиті В; коінфекція, вплив медикаментів/токсинів, імунодефіцит ний стан). Але такі зміни спостерігаються відносно рідко. Виявлення незначних ступінчастих та внутрішньочасточкових некрозів є менш важливим для клінічного перебігу, тому надмірна деталізація в таких випадках не є необхідною.
- Визначення стадії процесу є основним критерієм при розробці схеми лікування, враховуючи значні побічні впливи ліків та сумнівність повної ерадикації вірусів. Тому простота та легкість сприйняття використовуваної схеми в цьому питанні особливо важливі.
- При поєднаних ураженнях визначення індексу гістологічної активності та фіброзу може бути недостатнім для розробки лікування та розуміння прогнозу захворювання. В таких випадках великого значення набувають додаткові зміни.
- Виходячи з цього доцільно описувати найчастіші з них при кожному дослідженні у коментарі. До таких змін відносяться стеатоз, гемосидероз та велико- або дрібноклітинні зміни.
Таким чином, незважаючи на значні успіхи у розробці нових методів клінічного обстеження хворих, біопсійне дослідження на сьогодні лишається актуальним. Але, оскільки процедура є інвазивною і зрідка може супроводжуватись ускладненнями, необхідно чітко дотримуватись загальноприйнятих положень на всіх етепах її проведення (оцінка показів та протипоказів, забір матеріалу, його обробка та формулювання патогістологічного заключення) [13,14].
Дуже важливим є контакт мміж патоморфологом таа клініцистом, від якого залежать як технічні аспекти, так і виявлення патоморфологічних проявів, що мають значення для діагностики, лікування та оцінки прогнозу захворювання.
Література
- Шерлок Ш., Дули Дж. Заболевания печени и желчных путей. М.: «Гэотар» Медицина, 1999.- 864 с.
- Павлов Ч.С., Ивашкин В.Т. Биопсия печени: методология и практика сегодня // Рос. журн. гастроэнтерол., гепатол., колопроктолог. – 2006.- Т. , №4.- С.65-77.
- Rosai and Ackerman’s Surgical Pathology, Ninth edition, Mosby,2004.- 2911p.
- Scheuer P.J, Lefcowitch J.H. Liver biopsy interpretation, sixth edition, W.B. Saunders, 2000.- 381 p.
- Robbins and Cotran Pathologic basis of Diseases, seventh edition, Elsevier Saunders, 2005.- 1524 p.
- Щербинина М.Б., Баринов И.В., Будзак И.Я. Диагностические возможности и реальное использование в клинике пункционной биопсии печени // Сучасна гастроенетерологія.-2004.-Т.17,№3.-С.27-31
- Knodell R.G., Ishak K.G., Blaack W.C. et al. Formulation and application of a numerical scoring system for assessing histological activity in asymptomatic chronic active hepatitis // Hepatology .-1981 .- N1 .-P.431-435
- Scheuer P.J Classification of viral hepatitis: a need for reassessment // J Hepatol .-1991 .-V.13 .-P.372-374
- Scheuer P.J., Standish R.A., Dhillon A.P. Scoring of chronic hepatitis // Clin Liver Dis .-2002 .- V.6 .-P.335-347
- Batts K.P., Ludwig J.Chronic hepatitis. An update on terminology and reporting // Am J Surg Pathol .-1995 .-V.19 .-P.1409-1417
- Ishak K., Baptista A., Bianchi L. et al. Histological grading and staging of chronic hepatitis // J Hepatol .-11995 .-V.22 .-P.696-699
- Desmet V.J. Histological classification of chronic hepatitis //Acta Gastroenterol Belg .-1997 .-V.60 .- P.259-267
- Theise N.D. Liver biopsy assessment in chronic viral hepatitis: a personal practical approach // Modern Pathology .-2007 .-V.20 .-P.3-14
- Guido M. Rugge M. Liver biopsy sampling in chronic viral hepatitis // Semin Liver Dis .-2004 .-V.24 .-P.89-97


