Гепатологія – 2008. – № 1. – С. 44–52.
Вступление
Передача HBV от матери плоду и новорожденному ребенку является одним из основных путей естественной, т.е. несвязанной с медицинскими вмешательствами, части эпидемического процесса при гепатите В. Из всех возможных путей передачи возбудителя плоду и новорожденному ребенку наибольшее эпидемиологическое значение имеет заражение в родах: так называемая интранатальная передача. На ее долю приходится 80-90% всех заражений в антенатальном и перинатальном периодах (рис.1). Это связано с тем, что во время родов происходит микротравмирование кожи плода (мацерация), инфицирование конъюнктив, аспирация околоплодных вод; возможны также материнско-плодовые инфузии и др.[1–5]. Во время родов плод «купается» в инфицированной жидкости, что естественно делает высокой вероятность заражения.
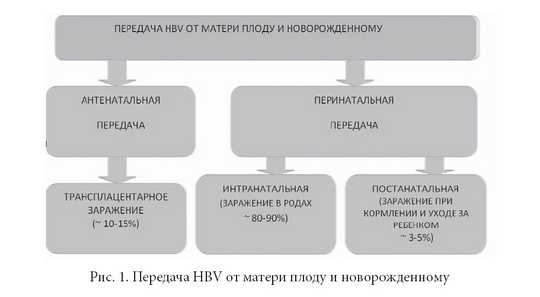
Инфицирование в раннем постнатальном периоде, связанное с особенностями питания и ухода за новорожденным, возникает нечасто, так как большинство заражений происходит в родах.
Случаи клинически манифестного врожденного гепатита В и «латентных» форм инфекции, подтвержденные выявлением HBV DNA в сыворотке венозной крови и в лейкоцитах в первые дни жизни, указывают на возможность трансплацентарной передачи. Однако этот вид передачи HBV, так же как и заражения, связанные с уходом и кормлением ребенка, считается второстепенным.
Это распространенное мнение представляется сомнительным: оно не соответствует особенностям эпидемического процесса в современных условиях. Дело в том, что перинатальные заражения эффективно контролируются вакцинацией новорожденных детей, в то время как трансплацентарная передача остается неуправляемой [6]. Понятно, что в таких условиях неминуемо возрастает удельный вес заболеваний, связанных с заражением в антенатальном периоде. Нельзя игнорировать и то, что врожденный гепатит B протекает значительно тяжелее, чем гепатит, возникающий спустя несколько месяцев после рождения, и практически всегда переходит в ХГВ, чаще он развивается как первично хронический.
Количество заражений в антенатальном периоде обычно оценивают по частоте врожденного гепатита B. В этом случае не принимаются во внимание различные виды акушерской патологии, в том числе те, из-за которых беременность не завершается рождением ребенка.
Известно, что частота акушерской патологии в анамнезе женщин с хронической НВ-вирусной инфекцией достоверно коррелирует с персистенцией HBeAg в крови. Так, ранние выкидыши отмечены в анамнезе 25,7% женщин с хронической персистенцией НBsAg и HBeAg, и лишь у 3,5% при наличии только НBsAg [7]. Хотя не все случаи акушерской патологии у женщин с хронической НВ-вирусной инфекцией обусловлены именно заражением через плаценту, игнорировать такую возможность нельзя. По- нашему мнению, значение этого вида передачи HBV недооценивается.
Исследование трансплацентарной передачи не должно ограничиваться обследованием новорожденных, следует учитывать разные формы акушерской патологии. Особо актуально, по нашому мнению, изучение патогенетических механизмов трансплацентарной передачи, так как это может дать ключ к решению проблемы профилактики заражений в антенатальном периоде. Именно этот аспект проблемы и является предметом нашего сообщения.
Материал и методы исследования. Для изучения патогенеза трансплацентарных заражений HBV исследовали иммунологическое «равновесие» в системе «мать-плод» у женщин с репликативной формой ХГВ, заразивших (основная группа) и не заразивших своих детей (группа сопоставления). Как показатель, характеризующий иммунорегуляторную функцию плаценты, учитывали уровень иммунносупрессорной активности сыворотки крови и функциональную активность материнского пула лейкоцитов [8,9].
Известно, что весомая часть факторов, предопределяющих плодо-материнскую толерантность, не имеет четкой специфической направленности и может влиять на многообразные процессы [10]. Существует множество способов оценки иммуносупрессорной активности сыворотки крови беременной женщины. В опытах in vitro такая сыворотка подавляет бластотрансформацию лимфоцитов и синтез цитокинов в культуре лейкоцитов, Е-розеткообразование, уменьшает киллерную активность, тормозит спонтанную миграцию лейкоцитов и тому подобное [11,12,13].
Для лейкоцитов, выделенных из крови женщины с физиологической беременностью, характерна сниженная функциональная активность, в частности, меньшая способность к розеткообразованию, бластотрансформации и ослабленная локомоторная функция (спонтанная миграция лейкоцитов).
Из набора тестов, ранее предложенных нами для иммунологического контроля течения беременности [13,14], для данного исследования были выбраны методики изучения иммуносупрессорной активности сыворотки крови по ингибированию Е-РОК донора и определения локомоторной активности материнских лейкоцитов.
Под нашим наблюдением находилось 117 беременных женщин с репликативной формой ХГВ, беременность у них завершилась рождением ребенка. Новорожденных в первые один-два дня жизни обследовали методом PCR на наличие в периферической крови HBV DNA.
Результаты обследования новорожденных детей ретроспективно сопоставляли с показателями иммуносупрессорной активности материнской крови и активностью материнских лейкоцитов (исследование проводили в І и ІІ триместрах беременности).
Для определения способности лейкоцитов к миграции (локомоторная активность) клетки, выделенные из периферической венозной крови, вносили в лунки, вырезанные в геле агара, и измеряли расстояние, на которое они удалялись от края лунки.
Ход исследования
Приготовление среды-покрытия. 25мг агара «Дифко» разводят в 5 мл 0,85% раствора хлорида натрия и стерилизуют в течение 15 минут при 1,5 атм. В раствор охлажденного до 65º С агара вносят 20 мл теплой среды №199 с 10% лошадиной сыворотки (50ºС), перемешивают и переносят в чашку Петри. Чашку с застывшим агаром помещают в эксикатор, содержащий СО2 (25% от объема эксикатора), рН геля – 7,2.
Приготовление лейкоцитарной массы. Лейкоциты выделяют из гепаринизированной венозной крови с помощью З% раствора желатины, дважды отмывают в охлажденном растворе Хенкса центрифугированием при 200 g в течение 10 минут. Осадок ресуспендируют в среде №199 с 10% лошадиной сыворотки, доводят до концентрации З x 106 и вносят в лунки, вырезанные в агаровом покрытии непосредственно перед заполнением (диаметр лунок 3 мм, объем – 0,05 мл). Лейкоциты в лунках в агаровом покрытии инкубируют при 37ºС в атмосфере СО2 (5% от объема газовой смеси) в течение 4-5 часов, после чего определяют их локомоторную активность. Для этого измеряют зону миграции при малом увеличении микроскопа с помощью окулярного микрометра или окуляра с сеткой. Учитывают наибольшую ширину кольца вокруг лунок одной серии, результаты выражают в условных единицах (у.ед.).
Для определения иммуносупрессорной активности крови беременной женщины лейкоциты донора предварительно инкубируют с исследуемой сывороткой крови.
Ход исследования. Лейкоциты донора выделяют из венозной крови по описанной выше методике. Клеточную суспензию инкубируют с равным объемом исследуемой сыворотки, предварительно разведенной изотоническим раствором натрия хлорида в соотношении 1:2 (в течение 60 мин. при температуре 37ºС). После этого клетки отмывают в среде №199 центрифугированием при 200 g в течение 10 мин. Осадок ресупендируют в среде №199 до конечной концентрации 3 х 106 и смешивают с равным объемом 0,5% суспензии отмытых бараньих эритроцитов.
Смесь клеток инкубируют при 4º С 180 мин. После инкубации клетки осаждают центрифугированием при 100 g в течение 5 мин. Из осадка готовят препараты и определяют процент розеткообразующих лимфоцитов. В качестве контроля используют лимфоциты, предварительно инкубированные с сывороткой крови небеременной женщины. Как показатель, указывающий на достаточную иммуносупрессорную активность сыворотки крови беременной женщины, учитывают снижение количества Е-РОК (по сравнению с контролем) на > 40%.
Результаты и обсуждение. При обследовании детей, рожденных матерями с репликативной формой ХГВ, у 18 (15,3%) в первые 1–2 дня жизни в крови выявлена HBV DNA.
Ретроспективный анализ показал, что у матерей, трансплацентарно заразивших детей, в периоде беременности наблюдалось выраженное в разной степени уменьшение иммуносупрессорной активности сыворотки крови. Так, 12 исследуемых образцов (66,7%) лишь незначительно влияли на показатель Е-РОК: уменьшение показателей розеткообразования не превышало 10% (выраженная недостаточность супрессорной активности); в 4-х опытах (22,2%) иммуносупрессорное влияние сыворотки было умеренным: угнетение Е-РОК не превышало 15-20%. Две исследуемые сыворотки крови (11,1%) попали в так называемую «серую зону», так как их подавляющая Е-РОК активность составляла 36% и 39%, т.е. несущественно отличалась от принятой за физиологическую (угнетение Е-РОК на > 40%).
В группе сопоставления (матери, родившие здоровых детей) иммуносупрессорная активность сыворотки крови была значительно интенсивнее. Исследованные образцы из этой панели сывороток в большинстве опытов (91 из 99; 91,9%) вызывали снижение показателя Е-РОК на >40 %; под влиянием восьми исследованных сывороток показатель розеткообразования уменьшился до 20-30% (рис. 1).
О снижении супрессорной активности крови у женщин из основной группы свидетельствовала и высокая локомоторная активность лейкоцитов. В большинстве опытов показатель миграции материнских лейкоцитов превышал 20 у. ед, практически не отличаясь от локомоторной активности лейкоцитов, выделенных из периферической крови женщин вне беременности. Лейкоциты, полученные от женщин родивших здоровых детей, оказались менее активными – расстояние, на которое они мигрировали, не превышало 15 у.ед. (табл.1).
Таблица 1. Локомоторная активность лейкоцитов периферической крови беременных женщин.
|
миграция лейкоцитов в у. ед. |
Основная группа (n=18) |
группа сопоставления (n=99) | женщины вне беременности (n=20) | ||
|
1 триместр |
2 триместр |
1 триместр |
2 триместр |
||
| До 10 |
– |
– |
49 |
38 |
– |
| 10-15 |
– |
– |
50 |
61 |
– |
| 16-19 |
2 |
– |
– |
– |
5 |
| ³ 20 |
16 |
18 |
– |
– |
15 |
Таким образом, в наших исследованиях установлено, что беременные женщины с репликативной формой хронической НВ-вирусной инфекции, заразившие и не заразившие своих детей, отличаются по уровню иммуносупрессорной активности сыворотки крови и функциональной активности лейкоцитов. С учетом того, что супрессорная активность сыворотки крови является важным условием плодо-материнской толерантности, приходится признать, что трансплацентарная передача HBV связана с неблагоприятными для плода взаимоотношениями в системе «мать – плод».
Известно, что активация клеточного и гуморального иммунитета препятствует становлению механизмов, защищающих плод от иммунной системы матери, и сопровождается нарушением плодо-материнской толерантности [9]. То, что трансплацентарная передача возникала на фоне недостаточной иммуносупрессорности беременной женщины, позволяет сделать заключение, что заражение плода является следствием цитопатогенного эффекта на клетки трофобласта, плаценты, плода. Возникает иммунная атака, во время которой возможна передача HBV инфицированными лейкоцитами. Допускаются и другие механизмы проникновения вируса, но все они – следствие иммунноопосредственного повреждения плаценты.
В связи с этим для предупреждения трансплацентарной передачи HBV перспективным представляется мониторинг иммуносупрессорной активности крови как показатель плодо-материнской толерантности. Раннее выявление и своевременная коррекция нарушений в супрессорности крови беременной женщины может оказаться одним из подходов к профилактике трансплацентарных заражений.
В плане разработки методов иммунокоррекции представляют интерес данные об эффективности препаратов, изготовленных из ретроплацентарной крови, при лечении гестозов, а также некоторых других состояний, в основе которых лежат аутоиммунные процессы [15,16]. В последние годы появились сообщения об эффективном использовании нормального иммуноглобулина человека для внутривенного введения при лечении многих аутоиммунных состояний, в том числе иммуннозависимого бесплодия [10]; мы предложили способ лечения аутоиммунных нарушений при хронических гепатитах с помощью внутрикожной иммунизации аутолейкоцитами [17]. Эти подходы могут явиться основой для усовершенствования методики иммунокоррекции неблагоприятных отношений в системе «мать-плод» и защиты плода от иммунной системы матери. Вопрос этот нуждается в дальнейшем изучении.
Действенным способом профилактики трансплацентарных заражений является также снижение уровня репликации HBV DNA в период, предшествующий беременности. Это положение можно проиллюстрировать следующим клиническим наблюдением.
Больная З., 29 лет, врач-педиатр. В связи с беременностью обследована на HBsAg, результат позитивный. Диагностован ХГВ, репликативная форма (HBеAg+). Самочувствие удовлетворительное, жалоб, характерных для хронического гепатита, небыло. Родила ребенка с врожденным гломерулонефритом, умер на 7 день жизни (в крови виявлена HBV DNA).
К нам обратилась через 6 месяцев после родов. Назначено лечение зеффиксом. Препарат получала на протяжении года. Произошла инверсия HBеAg, HBV DNA в сыворотке крови не виявлена. Забеременела. В третьем триместре беременности снова в крови появился HBеAg, однако родила здорового мальчика. Таким образом, в результате временного снижения интенсивности репликации удалось предотвратить трансплацентарное заражение.
Ребенок был вакцинирован против гепатита B. Наблюдение в течение года заболевания гепатитом B не выявило.
Выводы
- Трансплацентарная передача HBV происходит у беременных с интенсивной репликацией HBV DNA в условиях снижения иммуносупрессорной активности иммунологического гомеостаза (нарушение плодо-материнской толерантности). Мониторинг иммуносупрессорной активности крови и ее коррекция может оказаться перспективным способом предупреждения трансплацентарной передачи HBV.
- Для уменьшения угрозы передачи HBV целесообразно обследовать женщин детородного возраста, особенно с отягощенным акушерским анамнезом, на маркеры гепатита В. Противовирусная терапия женщин детородного возраста с репликативной формой ХГВ способствует снижению угрозы антенатальной передачи HBV и должна рассматриваться как важное условие подготовки к запланированной беременности.
ЛИТЕРАТУРА
- Фарбер Н.А., Мартынов К.А., Гуртовой Б.Л. Вирусные гепатиты у беременных // М.: Медицина.– 1990.–208 с.
- Герасун Б.А. Вирусный гепатит В с естественными путями передачи. Автореф. дисс. … д.м.н. –Ленинград.–1985.– 44 c.
- Балаян М.С., Міхайлов М.І. Енциклопедичний словник – вірусні гепатити // Львів: ЛДМУ, 2000.– 584с.
- Игнатова Т.М. Хронические заболевания печени вирусной и невирусной этиологии у беременных : тактика ведения, лечения // Информационный бюллетень «Вирусные гепатиты».– 2002.–№1. – 3–10.
- Шерлок Ш., Дули Дж. Заболевания печени и желчных путей / Пер. с англ. – М.: Геотар Медицина, 1999. – 859 с.
- Ghendon Y. Perinatal transmission of hepatitis B virus in high-incidence countries. // J.Virol. Methods.1987.– V.17.–P.69–79.
- Беседин В.М., Герасун Б.А, Шевченко Л.Ю. Жовтяниці у вагітних // Львів: ЛДМУ.– 1999.– 240 с.
- Knobloch V., Miler I. The development of immunological relationship between mother and fetus under physiological and pathological conditions // Allergie and Immunol. – 1988. – №4. – P.219–231
- Говалло В.И. Иммунология репродукции // М.: Медицина.–1987.– 394 с.
- Дранник Г.Н. Клиническая иммунология и аллергология // М.: ООО «Медицинское информ.агентство».– 2003.– 604 с.
- Григорьева В.В., Сельков С.А., Шалахова О.В. и др. Активность естественных киллеров при различных формах невынашивания беременности // Акушерство и гинекология.–1991.–№4.– С.26-28.
- Головистиков И.Н. Горлина Н.К. Асиурова Р.А. и др. Влияние белков, ассоциированных с беременностью, на выработку фактора, угнетающего мигрaцию лейкоцитов (ФУМ-Л) периферической крови человека // Иммунология.–1993.–№3.– С.66–68.
- Булиенко С.Д., Беседин В.Н., Герасун Б.А. Иммунологический контроль за течением беременности. В кн.: Иммунология репродукции // Киев.–1990. – С.120.
- Беседин В.Н., Герасун Б.А. Мониторинг чувствительности лимфоцитов к аутосыворотке и антилимфоцитарному иммуноглобулину при беременности // Иммунология.–1990.–№4.– С.66-67.
- Беседин В.Н. Коррекция нарушений гомеостаза у беременных с поздним токсикозом // Автореф. дисс. … д.м.н. –К.– 1990.– 44 с.
- Карпенко В.Г. Імунні порушення у вагітних з анемією та їх імунокорекція // Педиатрия, акушерство и гинекология .- 1994 – №2 – С. 41-43.
- Герасун Б.А., Чоп’як В.В., Ворожбіт О.Б. Імунізація автолейкоцитами – новий спосіб лікування автоімунних порушень у хворих на хронічні гепатити // Гепатологія.– 2008.–№1.– С.
Антенатальна передача гепатиту В.
Обстежено 117 вагітних жінок, хворих на HBeAg-позитивний ХГВ, та 18 народжених ними дітей. Встановлено, що в матерів, які трансплацентарно заразили дітей, підчас вагітності спостерігалося зменшення притаманної процесу гестації імуносупресивної активності сироватки крові. Виказана гіпотеза, що порушення материнської толерантності по відношенню до плоду призводить до цитогенного ефекту з ушкодженням плаценти, і сприяє передачі HBV.
Ключові слова: гепатит В, вагітність, трансплацентарна передача HBV, антенатальна передача HBV, перинатальна передача HBV, інтранатальна передача HBV.
Antenatal transmission of hepatitis B.
Examination of 117 pregnant women and 18 children who were born from them. It was determination that children contaminated transplacental were born from mothers who had immunosuppression activity of blood serum was reduced durig the pregnancy period. Evidently reduction of maternal tolerance causes to cytogenic effect and lesion of plancenta what to the transmission of HBV.
Key words: hepatitis B, pregnancy, antenatal transmission of HBV, placental transmission of HBV, intranatal transmission of HBV, perinatal transmission of HBV.


